Akutní promyelocytární leukemie (APL) je opravdu nejvyšším perakutním stavem v hematologii. Zejména kvůli tomu, že během několika hodin může vést ke smrti pacienta z důvodu akcentované koagulopatie s infaustním intrakraniálním krvácením. Jsou ovšem popsány i paradoxní trombózy – např. úmrtí v důsledku Budd-Chiariho syndromu, AIM nebo phlegmasia alba dolens. Ke smrti pacienta může dojít do několika hodin od nástupu příznaků.1
Děsivé, že? A nejděsivější na tom je to, že často tím hlavním faktorem, který rozhodne mezi životem a smrtí pacienta je lékař první linie, který na tuto diagnózu pomyslí. Proč tak akcentuji onen klíčový okamžik podezření na APL? Protože při časné diagnostice a léčbě je APL leukemií s nejlepší prognózou ze všech akutních myeloidních leukemií. V konkrétních číslech – podle recentních dat při časné terapii dlouhodobě přežívá 95 až 98% pacientů!2
Nejdříve něco patofyziologie a patologie na úvod. APL je maligním klonálním onemocněním hematopoézy. Jedná se o podskupinu akutních myeloidních leukemií s charakteristickou expresí fúzního genu PML/RARalfa (t15,17) v leukemických buňkách a přítomností patologických promyelocytů v nátěru z aspirátu kostní dřeně. Vlivem maligního zvratu dochází k útlumu krvetvorby, typicky všech tří linií. Vlivem fúzního genu PML/RARalfa vzniká aberantní deviovaný retinoidní receptor, který vede k blokaci transkripce a diferenciace buněk. Vyskytuje se asi v 8% případů všech akutních myeloidních leukemií dospělých, medián věku se pohybuje kolem 47 let. V ČR diagnostika APL trvá bohužel dlouho a to přináší vyšší míru mortality pacientů.3
Mezi typické projevy patří únava, dušnost, petechie, krvácivé projevy, infekce s perakutním průběhem a v krajním případě i zmíněné trombotické komplikace. Pro APL je velmi typická těžká koagulopatie s trombocytopénií, laboratorně se jedná o DIC. Nejzávažnější komplikací je spontánní intracerebrální krvácení, které je prakticky vždy infaustní.4
Co musí vést lékaře k suspekci na APL? V první řadě obraz pancytopenie. Diferenciální diagnostika pancytopenií je strašlivá, ale v první řadě musí na mysl, vzhledem ke své urgenci, přijít APL. V mikroskopickém diferenciálním rozpočtu se v atypických případech mohou objevit leukemické promyelocyty. To ale bohužel není pravidlem a častěji se v periferní krvi objevuje jen minimum nezralých granulocytů.
Dalším red flag je obraz konzumpční koagulopatie. Klinické projevy zvýšené krvácivosti často bývají vyšší než je míra laboratorní trombocytopenie, proto je klinické vyšetření naprosto kruciální. V koagulačních testech se obvykle APTT nijak neliší od normálu, bývá někdy mírně prodloužené. Typicky je ale hodnota fibrinogenu nízká, bývá prodloužený Quickův čas a hodnoty D-dimerů jsou výrazně zvýšené.
A tady vlastně končí práce lékaře první linie, který by měl vyslovit podezření na možnou APL a konzultovat stav s hematologem, následně zorganizovat transport pacienta do centra intenzivní hematologické péče. Ovšem k bezpečnému transportu je nutné pacienta zajistit podpůrnou terapií, dokud není podána léčba specifická.
Mezi podpůrnou terapií patří udržení hladin fibrinogenu nad 1,5 g/l a trombocytů nad 30 – 50×109/l. České doporučené postupy říkají, že rutinní podání antifibrinolytik nepřináší žádný benefit.5 Zahraniční studie zkoumaly vliv kyseliny tranexamové na incidenci fatálních krvácivých komplikací při APL a ta byla ve skupině TXA výrazně nižší.6,7 Důležitým upozorněním je, že do korekce koagulopatie by pacientům neměl být zaváděn CŽK ani jiné invazivní vstupy pro riziko ireverzibilního krvácení!
Následující postup už probíhá v centru intenzivní hematologické péče, kde lékem první volby při indukci u APL je kyselina all-transretinová (ATRA). Její podání je indikováno co nejdříve po vyslovení suspekce na APL i bez pozitivity testů potvrzujících diagnózu. ATRA totiž v případě APL velmi rychle koriguje přítomnou koagulopatii, a tak je kauzální prevencí a léčbou možných krvácivých komplikací. U pacientů s vysokým rizikem je často terapie kombinovaná – a to ATRA + oxid arsenitý (ATO) + idarubicin, případně gemtuzumab ozogamicin.5 To je ale už mimo rozsah mého sdělení (a chápání).
V závěru ještě zmíním jednu komplikaci, se kterou se při léčbě APL můžete setkat. Ale opět spíše pro zajímavost, neboť terapie probíhá v centrech intenzivní hematologické péče.
Jedná se o diferenciační syndrom. Vlivem podání indukční dávky ATRA (zejm. v kombinaci s ATO) dojde k akcelerované diferenciaci promyelocytů do zralejších forem granulocytů, což je vlastně kýžený efekt celé terapie. Ale u rizikových pacientů, zejména u těch s iniciální leukocytózou, se může rozvinout diferenciační syndrom, který se projevuje retencí tekutin, pleurálním a perikardiálním výpotkem, dušností nebo intersticiálními plicními infiltráty. V krajním případě může progredovat do multiorgánového selhání. Jeho prevencí je podávání kortikosteroidů a chemoterapeutik spolu s ATRA u rizikových pacientů s vstupní leukocytózou. Pokud se i tak objeví, terapie spočívá v podávání dexamethasonu, někdy je i nutné diferenciační léčbu pozastavit.5
Mimochodem ATRA má vysoký potenciál prodlužovat QT/QTcB interval, a proto je při jejím podání nutné kontinuální monitorování EKG. V případě prodloužení QT nad 500 ms je indikováno pozastavení ATRA do zkrácení QT pod 460 ms – samozřejmě spolu s event. korekcí hypokalémie a hypomagnezémie.5
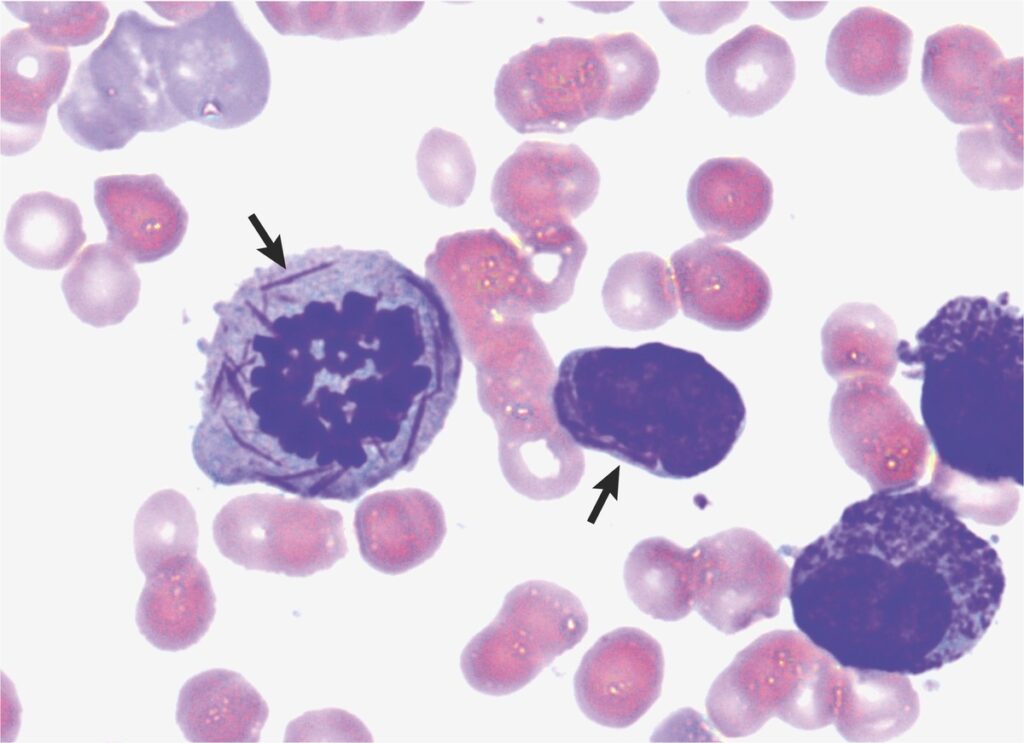
Závěrem přidávám myelogram z aspirátu kostní dřeně, kde můžeme vidět obraz tzv. faggot cells a přítomnost Auerových tyčí, což bývá u APL typickým nálezem – ale ani to není pravidlem, jak jsem se dočetl.
Takže kdy na APL myslet? Ve zkratce u pacienta, který je dušný, výrazně vyčerpaný a má projevy zvýšené krvácivosti. V krevním obraze nalezneme obvykle obraz pancytopenie, v koagulačních parametrech zejména prodloužení INR, snížený fibrinogen a extrémní elevaci D-dimerů – neboli obraz konzumpční koagulopatie.
Zdroje
1 – Vnitř Lék 2008; 54(7&8): 728–744
2 – https://www.cancer.gov/news-events/cancer-currents-blog/2023/leukemia-apl-preventing-early-death
3 – Lemež P, Schwarz J, Jelínek J et al. Pozdní a pomalá diagnostika akutních promyelocytárních leukemií – hlavní příčina časných smrtí. Vnitř Lék 1994; 40: 654–659
