Magnesium neboli hořčík je nezbytným stavebním prvkem v lidském organismu, kde se vyskytuje ve formě kationtu. Je zapojen do více než 300 metabolických reakcí a je přímo zapojen do dějů zahrnujících metabolismus ATP. Jeho název pochází z řecké oblasti Magnesia, kde ho používali již starověcí lékaři pro mnohé neduhy.
V lidském těle se nachází asi 25 gramů magnesia, z toho 1% je extracelulárně, 60% v kostech a 39% intracelulárně. Extracelulárně prostupuje skrze membrány volně, nebyl u něho popsán Gibbs-Donnanův efekt. Intracelulárně se váže na ATP, lipidové části buněk a enzymy. Vykazuje stabilizační funkce na membrány. Intracelulární vstup probíhá bez aktivního transportu. Pouze 30% perorálně přijatého magnesia se vstřebá, podléhá složitým procesům absorbce. Vylučování probíhá zejména ledvinami, ale v dlouhodobém hledisku je i možné jeho ukládání intraoseálně.1 Co se týče buněčného hlediska, z buňky dochází k jeho efluxu díky Na+/Mg2+ aktivnímu transportéru. Pokud byste si mysleli, že buňky jsou schopny substituovat plazmatickou hypomagnezémii, jste na omylu. Bylo prokázáno, že na hypomagnesemii spíše zemřeme než aby se buňky vzdaly svého magnesia.2 Mechanismus zůstává neznámý, ale vysvětluje se jeho kofaktorová účast při syntéze PTH.
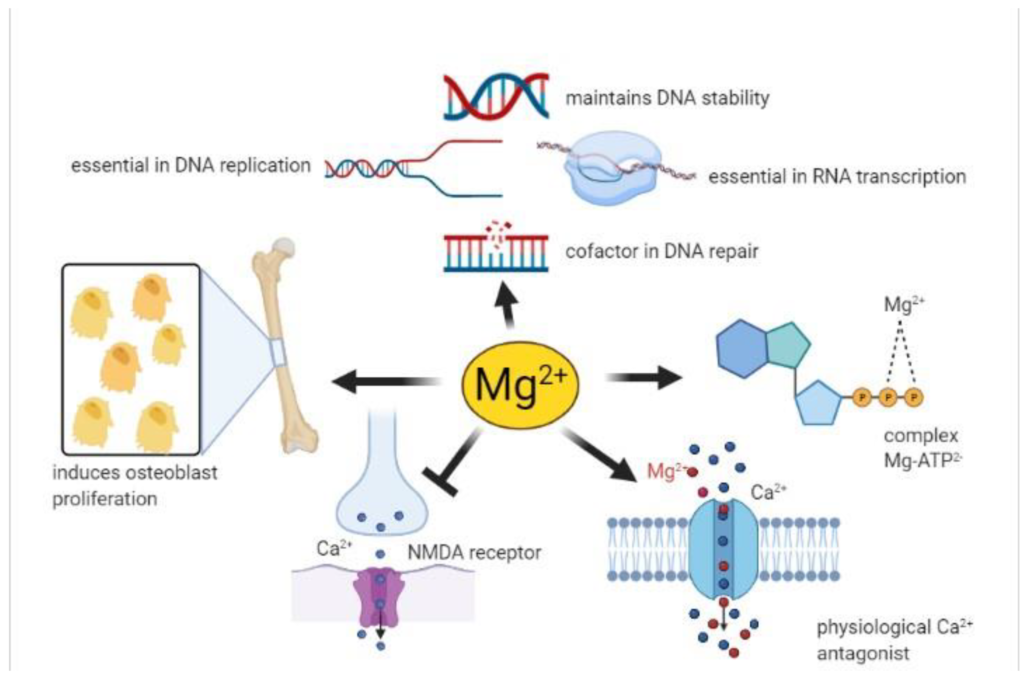
Mezi jeho fyziologické funkce patří enzymatické procesy (ATPázy, funkce kreatinkináz, enolázy), membránové funkce (přestup sodíku a kalcia), strukturální funkce (folding proteinů, syntéza nukleové kyseliny). Má významný vliv na správnou funkci mitochondrií. Dosud neznámým způsobem ovlivňuje funkci příštítných tělísek. Vykazuje antagonistické působení vůči kalciu – svalová relaxace, NMDA mediovaná neurotransmise. Prodlužuje vedení akčních potenciálů a vyvolává významnou relaxaci hladké svaloviny.
A co jeho farmakodynamické účinky?
V respiračního systému vyvolává bronchodilataci díky antagonizaci účinku kalcia, ve vysokých dávkách může způsobit paralýzu dechových svalů.
Co se týče kardiovaskulárního systému, tam se jeho účinky poměrně rozšiřují. Působí antiarytmicky (funguje jako blokátor kalciových kanálů4), zpomaluje vedení AV uzlem (stejný mechanismus) a díky indukovanému zvýšenému reuptaku kalcia sarkoplazmatickým retikulem vede k vazodilataci (to vyvolává i tokolýzu).
Ve svých účincích na CNS a PNS má taktéž široké mechanismy působení. Vykazuje antikonvulzivní atributy díky postsynaptické inhibici NMDA receptorů (stejným mechanismem vyvolává i analgézii3) a snižuje uvolňování acetylcholinu na nervosvalové ploténce.
Díky těmto mechanismů lze i odvodit možné závažné nežádoucí účinky, a to zejména paralýzu dechových svalů, hypotenzi a bradykardii.
Než se pustíme do možných použití v akutní medicíně, připomeňme si projevy hypo/hypermagnezémie:
- Hypermagnezémie -> nausea, flush, letargie, svalová slabost, hypopnoe, hyporeflexie, zástava dechu, atrioventrikulární disociace s následnou zástavou oběhu
- Hypomagnezémie -> arytmie, hypertenze, depresivní symptomatologie, zvýšená nervosvalová dráždivost, hyperreflexie, spasmy, fascikulace, pozitivní Chvostkův příznak
Pro úplnost nutno zmínit, že hypomagnezémii velmi často provází i hypokalémie a lze to v akutní medicíně často očekávat u předávkování beta2-sympatomimetiky!5
Nyní k možnému využití v akutní medicíně.
Začněme asi tou nejznámnější indikací, a to podáním u maligní arytmie typu Torsades de Pointes. TdP je formou polymorfní setrvalé (většinou) komorové tachykardie s velmi nízkým srdečním výdejem. Představuje riziko transferu do komorové fibrilace. Jsou asociovány s prodloužením QT intervalu. Dochází tak k prodloužené repolarizaci komor a rozvoji časné afterdepolarizace (EAD). Konečně dojde ke zpomalení inaktivace kalciových kanálů a vyvíjí se ideální terén pro rozvoj TdP. K tomuto patofyziologickému mechanismu je nejcitlivější endokard, ostatní vrsty méně. Objevuje se tak heterogenní arytmogenní stav a projeví se svým polymorfní patternem arytmie. TdP bývají vyvolány zejména iatrogenně (TCA, antiarytmika třídy Ia a III, antihistaminika, makrolidy). Zajímavá je asociace TdP se subarachnoideálním krvácením6. V terapii je nutné zkrátit QT interval a omezit afterdepolarizační atributy arytmie. Opatřením první volby je podání 2 g MgSO4+ bolusem během 2 minut, je taktéž nutné korigovat často se vyskytující hypokalémii. Jako druhou volbu lze zvolit lidokain/trimekain7. Podání amiodaronu je hrubou non lege artis chybou, která může vést k refrakterní maligní arytmii!
Mezi další často skloňované indikace patří pre/eklampsie. Eklampsie je definována jako epileptiformní aktivita asociována s preeklampsií. Mechanismem účinku je velmi pravděpodobně vyvolání vazodilatace mozkových cév a postsynaptická blokáda NMDA receptorů. Účinnost magnesia byla dokonce superiorní v porovnání s diazepamem a fenytoinem8. Doporučená dávka je 4g MgSO4 IV po dobu 5-10 minut, následovaných 1 g MgSO4/hod po dobu minimálně 24 hodin.
U bronchiálního asthmatu je účinek magnesia také znám dlouhou dobu. Díky vyvolání bronchodilatace skrze relaxaci hladké svaloviny funguje magnesium jako bronchodilatans. Je popisována i inhibiční schopnost na neutrofilní burst, a tak snížení zánětu zahrnující exacerbaci bronchiálního asthmatu. Oba dva účinky jsou mediovány skrze antagonizaci kalcia. Byl prokázán pozitivní účinek jednak IV magnesia, tak i magnesia nebulizováno, který byl přidán k standardní terapii – a to salbumatolu9. Podání IV magnesia u závažné exacerbace AB reflektují i ERC guidelines 2021. Magnesium lze s úspěchem podat i u exacerbace CHOPN, kde patofyziologický mechanismus je velmi podobný10.
Magnesium nachází i své uplatnění u intoxikace digoxinem, pokud nejsou ihned dostupné specifické digoxinové protilátky. Místem účinku je zde Na+K+ATPázová pumpa sarkolemy. Magnesium je bezpečným lékem k prevenci a terapii komorových arytmií indukovaných intoxikací digitalisem.11
Méně známou indikací je prevence a terapie migrenósního záchvatu. Díky čemu zde může být benefit? Magnesium přímo interaguje se serotoninovými receptory a inhibuje kalciem vyvolaný vasospasmus cév mozku. Lze i spekulovat o jeho antagonistických vlastnostech na postsynpatické NMDA receptory.12
Velmi zajímavou možností je jeho použití u akutního koronárního syndromu. Benefit je zde vysvětlován několika mechanismy – protichůdný efekt na kalcium, které je zodpovědné při svém influxu do postižených kardiomyocytů za jejich akcentovanou nekrózu, snížení tonu koronárních tepen a tedy zlepšení jejich perfúze a zvýšení thresholdu depolarizace kardiomyocytů, což může vykazovat antiarytmické účinky a preventovat rozvoj maligní arytmie při akutní ischémii myokardu. Některými studiemi byla prokázána nižší mortalita a menší riziko rozvoje levostranného srdečního selhání u pacientů, co dostali magnesium.13,14 Jeho místo v terapii akutního infarktu myokardu ale stále zůstává zahalené a čeká se zde na robustnější studie.
Další kardiologickou indikací podání magnesia je fibrilace síní s rychlou odpovědí komor. Jasně byl prokázán jeho synergistický efekt na ostatní antiarytmika prodlužující vedení AV uzlem (stejně jako magnesium) u pacientů s fibrilací síní a RVR. Přidání 4,5 gramů magnesia vedlo k úspěšnějšímu a rychlejšímu ukončení epizody FiS a RVR.15
Zřejmě minoritní indikací je renální kolika. Podání magnesia bylo porovnáváno s morfinem co se týče rychlosti nástupu účinku a míry analgézie. V dávce 50 mg/kg bylo magnesium stejně účinné v analgézii při stavu renální koliky. Morfin dosáhl maxima svého účinku v desáté minutě, magnesium v minutě dvacáté – ale vliv na VAS byl identický.16 Velmi pravděpodobně lze tento benefit přisoudit relaxačním účinkům na hladkou svalovinu.
Vzácnou ale závažnou diagnózou je feochromocytom, u kterého dochází k nadměrné autonomní paraneoplastické syntéze katecholaminů – lze tak očekávat sekundární hypertenzi, katecholaminergně indukované arytmie, flush, aj. Magnesium zde v případě feochromocytomové krize vykazuje pozitivní vliv zejména na katecholaminy indukované arytmie a extrémní vasokonstrikci vedoucí k sekundární hypertenzi17.
Ke konci se krátce zmíním o renesanci magnesia v anesteziologii. Podařila se prokázat asociace mezi podáním magnesia a snížené sympatické odpovědi na intubaci18. Přidání magnesia k IV terapii před nebo v průběhu operačního výkonu vede k nižší potřebě opiodní analgézie, a to zřejmě skrze svůj koanelgetický potenciál magnesia na postsynpatických NMDA receptorech19. Mezi další účinky v anesteziologické praxi lze zmínit nižší spotřebu sevofluranu při souběžném podání magnesia20, facilitaci neuromuskulární blokády nedepolarizujícími periferními myorelaxancii nebo nižší výskyt pooperační nausey, pokud bylo perioperačně podáno magnesium. Někteří autoři dokonce magnesium doporučují jako lék první volby pro perioperační hypertenzní špičku21.
Úplně na konec je nutno připomenout tu poslední ale naprosto logickou indikaci – hyperkalcémie. Zde ponechávám bez dalšího, neboť problematika byla vysvětlena již výše.
Jak lze vidět na uvedených datech, magnesium má své jasné místo v akutní medicíně a není radno ho podceňovat. V současné chvíli běží několik studií na jeho použití v arytmologii a neurologii na které se nelze než těšit. V psychiatrii jsou popsány velmi úspěšné augmentační mechanismy magnesia u těžkých depresivních fází a i v této problematice běží několik studií22. To je ale z jiného soudku…
Zdroje
Distribution and regulation of magnesium in the body fluids, Deranged Physiology
10 – Is magnesium sulfate effective for chronic obstructive pulmonary disease (COPD) flare-ups?, Cochrane
21 – Magnesium: an emerging drug in anaesthesia, British Journal of Anaesthesia
